TRANSFORMER UN SERVICE EN SOLUTIONS
THERAKOS® ECP EDGE PROPOSE UNE GAMME COMPLÈTE DE SERVICES DE SOUTIEN TECHNIQUE VISANT À AIDER LES PROFESSIONNELS DE LA SANTÉ À OFFRIR AUX PATIENTS UN SERVICE OPTIMISÉ D’IMMUNOMODULATION PAR PHOTOPHÉRÈSE EXTRACORPORELLE (ECP).
RENDEMENT
LE SYSTÈME DE PHOTOPHÉRÈSE THERAKOS™ CELLEX™ EST LA SEULE PLATEFORME D'ECP AU CANADA
- Le système CELLEX représente notre dernière innovation en matière de technologie intégrée d’immunomodulation par ECP.
- Le système CELLEX est un dispositif que nous nous engageons à améliorer en fonction de l’évolution de vos besoins. C’est pourquoi nous effectuons régulièrement des mises à niveau du système, conçues pour améliorer l’expérience utilisateur et offrir une administration optimale du traitement par ECP.
LA SOUPLESSE ET L’ADAPTABILITÉ FACILITENT LA PRESTATION DU SERVICE
- Le système CELLEX offre des caractéristiques fonctionnelles avantageuses:
- Système mobile et compact qui peut être facilement déplacé à l’intérieur de l’unité*
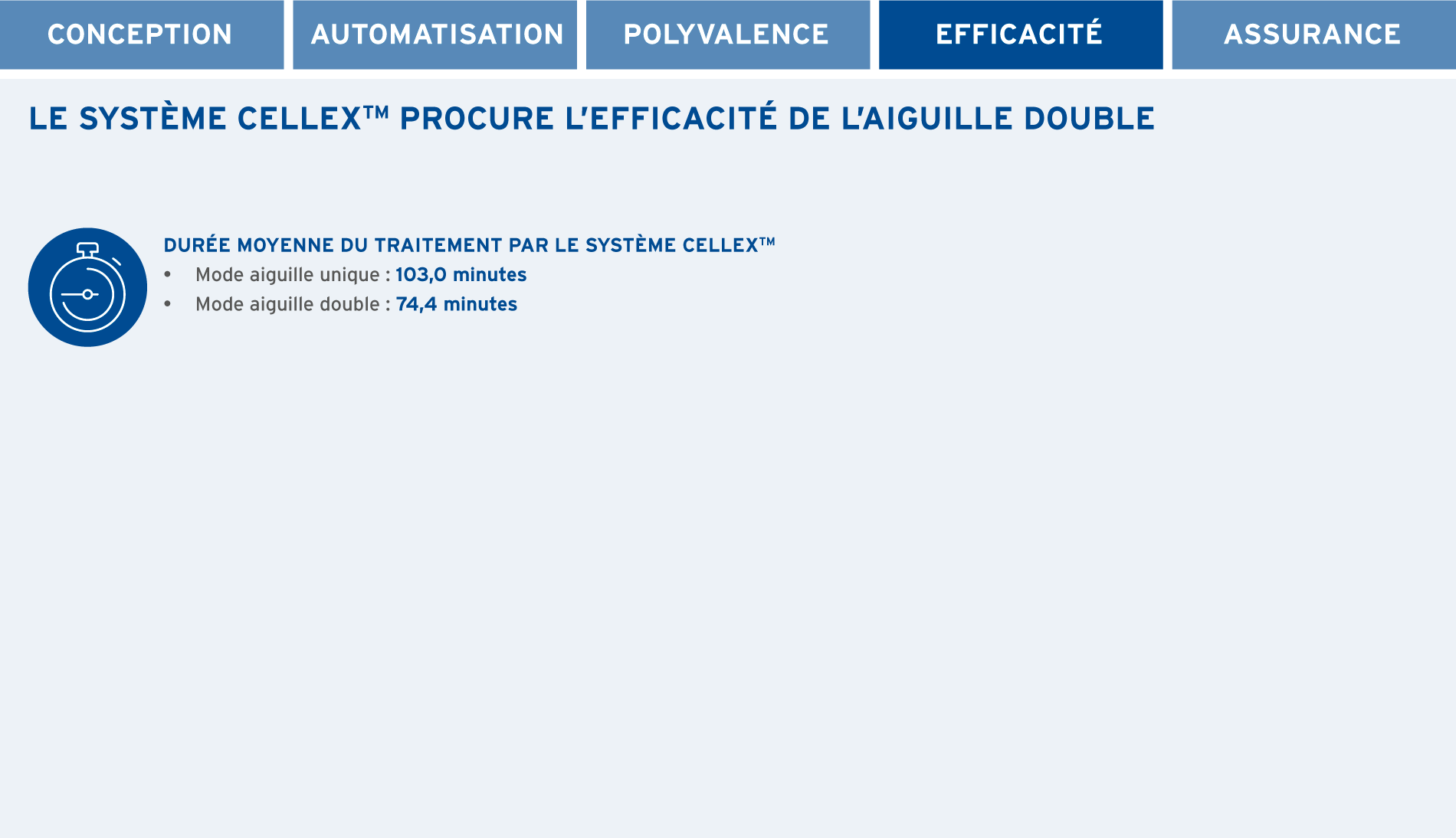
- Choix du mode aiguille unique ou aiguille double selon les conditions de l’accès veineux, et possibilité de passer d’un mode à l’autre à tout moment de la procédure1,2†
- Assistants de dépannage pour aider les opérateurs à trouver des solutions efficaces pendant les procédures d’ECP
* Avant de déplacer l’appareil, veuillez informer votre gestionnaire de compte clé de tout déplacement d’appareil dans votre unité. † Les opérateurs doivent utiliser leur jugement médical pour déterminer s’il faut administrer le traitement en mode aiguille unique ou aiguille double, en prenant en considération les besoins de chaque patient et les instructions présentées dans le manuel de l’opérateur.
TECHNOLOGIE VALIDÉE
LE SYSTÈME CELLEX™ EST LA SEULE PLATEFORME ENTIÈREMENT INTÉGRÉE ET VALIDÉE AU CANADA POUR L’ECP3
- L’intégration totale permet de garantir un processus totalement stérile et continu1,3,4.
-
Le patient reste relié au système CELLEX pendant toute la durée de la procédure, pour atteindre les résultats suivants:
- Réduire au minimum les erreurs de réinjection ou la contamination croisée4
- Réduire au minimum le risque de contamination microbienne4
ORIENTATION PATIENT ET CLIENT

FORMATION COMPLÈTE SUR LE FONCTIONNEMENT DE L’INSTRUMENT
- Formation initiale sur place sur le fonctionnement de l’instrument s’adressant au personnel infirmier et à d’autres professionnels de la santé
- Formation périodique sur place sur le fonctionnement de l’instrument pour aider les équipes de professionnels de la santé à se sentir plus à l’aise
- Soutien permanent sur place relativement aux procédures, y compris de la formation pour répondre aux besoins particuliers des patients
- Amélioration continue reposant sur la rétroaction des clients
THERAKOS INSTITUTE EN LIGNE
- Propose une gamme d’occasions d’apprentissage et de formation pour autodidactes avec un accès aux ressources suivantes:
- séances de formation sur l’ECP et l’immunomodulation;
- toutes les ressources de formation des opérateurs visant à optimiser les soins aux patients
IMMUNOMODULATION PAR THERAKOS® CELLEX®
EN QUOI CONSISTE L’IMMUNOMODULATION PAR THERAKOS CELLEX?
La photophérèse extracorporelle (ECP) est un traitement immunomodulateur qui a montré son efficacité chez les patients présentant des manifestations cutanées du lymphome cutané à cellules T ou une sclérodermie généralisée5.
COMMENT L’IMMUNOMODULATION PAR THERAKOS CELLEX EST-ELLE ADMINISTRÉE?
- L’immunomodulation par THERAKOS CELLEX est administrée à l’aide d’une plateforme d’ECP fermée, intégrée et automatisée : le système de photophérèse THERAKOS CELLEX1,3,4.
Pour en savoir plus sur les événements indésirables, les mises en garde et les précautions, veuillez consulter les Renseignements importants sur l’innocuité des systèmes de photophérèse THERAKOS®.




QUELLES SONT LES APPLICATIONS CLINIQUES DE L’IMMUNOMODULATION PAR THERAKOS® CELLEX®?
POSOLOGIE POUR LES PATIENTS PRÉSENTANT DES MANIFESTATIONS CUTANÉES DU LCCT, POUVANT ÊTRE AJUSTÉE SELON LA RÉPONSE DU PATIENT
Le système de photophérèse THERAKOS CELLEX est utilisé dans le traitement palliatif des manifestations cutanées du lymphome cutané à cellules T (LCCT) et de la sclérodermie généralisée. Seuls les professionnels de la santé formés à la photophérèse THERAKOS devraient administrer cette thérapie.
FRÉQUENCE NORMALE DE TRAITEMENT1
Le patient doit être traité deux jours consécutifs, chaque mois, pendant six mois.1 Une « réaction adéquate » est considérée comme une amélioration de 25 % du score cutané pour les patients présentant des manifestations cutanées du lymphome cutané à cellules T, et comme une amélioration de 15 % du score cutané pour les patients atteints de sclérodermie généralisée (voir la notice accompagnant le médicament pour la détermination du score cutané) au cours des huit premiers traitements, et son maintien pendant au moins quatre semaines1,7. La poursuite des traitements peut aboutir, ou non, à des améliorations supérieures à 25% et à 15%, respectivement.1,7
FRÉQUENCE ACCÉLÉRÉE DE TRAITEMENT1
Chez les patients qui ne manifestent pas une « réaction adéquate » après huit traitements, le calendrier des traitements peut passer à deux jours successifs toutes les deux semaines au cours des trois mois suivants1.
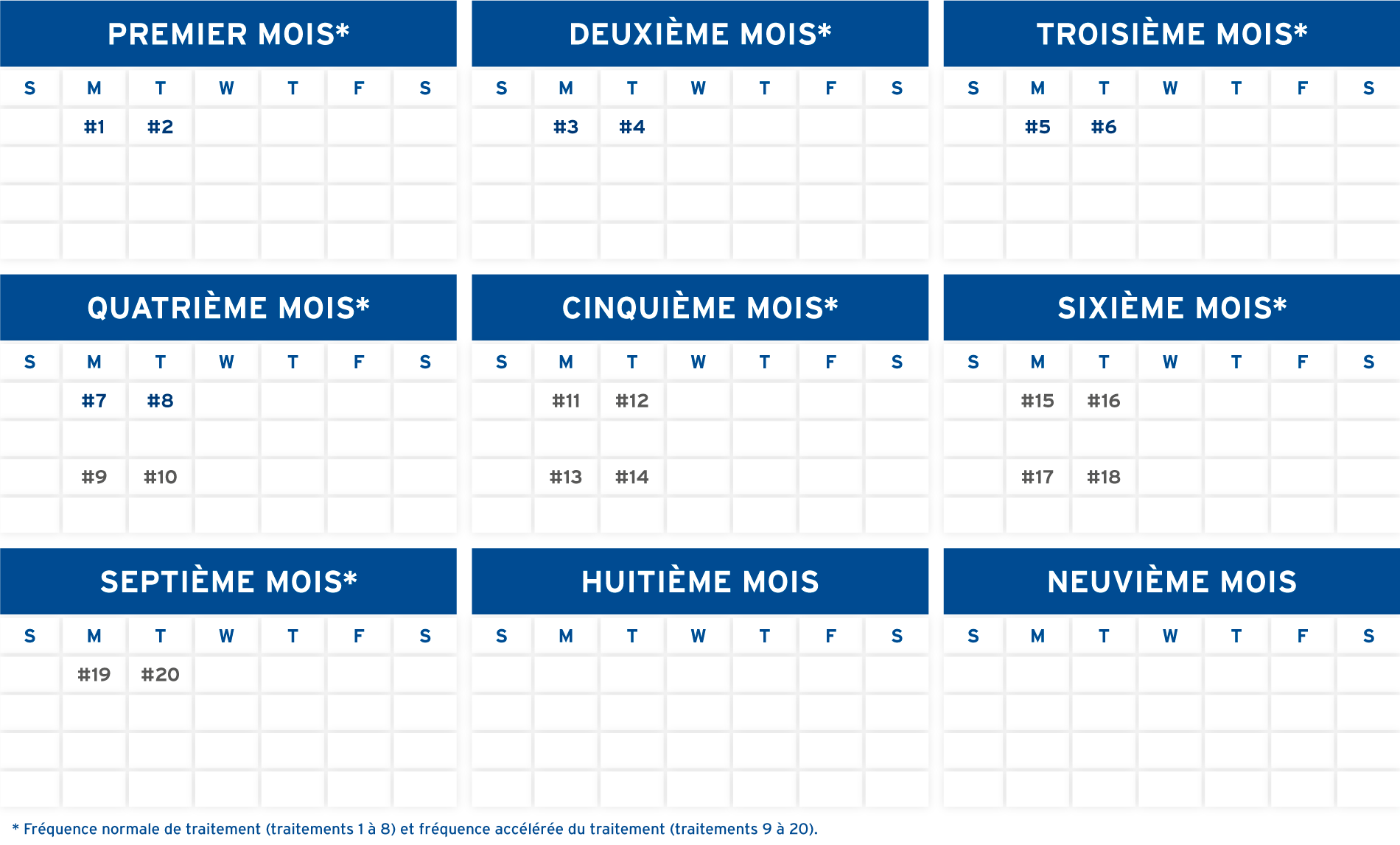
En l’absence de réponse ou en cas de réponse inférieure à la « réaction adéquate » au bout de 20 traitements, faites appel au jugement clinique pour décider si la photophérèse doit être interrompue1. Dans l’essai clinique portant sur le méthoxsalène (20 mcg/mL), 15 réponses sur 17 ont été constatées au cours des six mois suivant le début du traitement. Deux patients ont réagi au traitement après six mois1.
FRÉQUENCE DU TRAITEMENT D’ENTRETIEN1
Les patients ayant présenté une réponse positive dans les études cliniques ont été maintenus à un calendrier de deux jours de traitement consécutifs toutes les cinq semaines pendant au moins trois mois.1 Lorsque la réponse initiale est conservée avec ce calendrier, la fréquence de photophérèse peut être progressivement réduite et, dans certains cas, le traitement peut être arrêté. Toutefois, le médecin devrait continuer de suivre le patient régulièrement1.
LES MÉDECINS DOIVENT DÉTERMINER LE CALENDRIER DE TRAITEMENT APPROPRIÉ EN FONCTION DES BESOINS DU PATIENT.
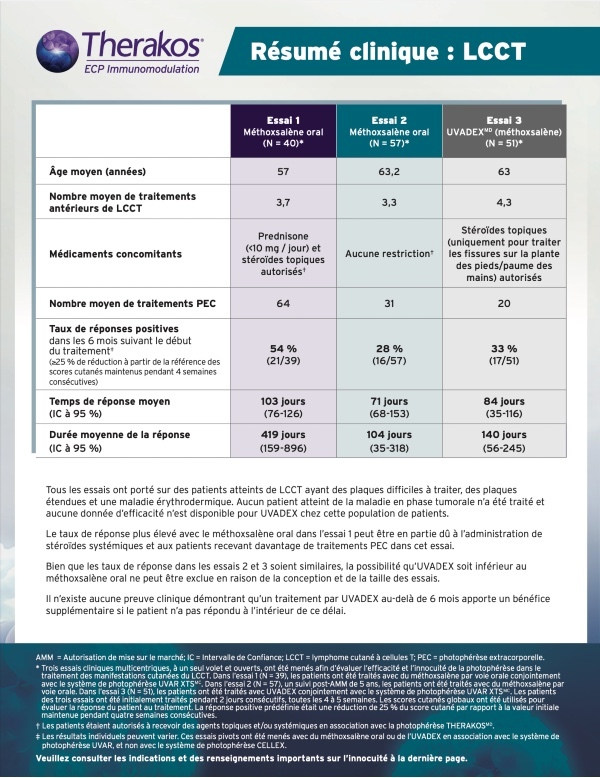
MANIFESTATIONS CUTANÉES DU LYMPHOME CUTANÉ À CELLULES T (LCCT)
DES RÉPONSES SIGNIFICATIVES, MÊME AVEC UNE MALADIE DIFFICILE À TRAITER6*
LA PHOTOPHÉRÈSE THERAKOS EXPLOITE LE SYSTÈME IMMUNITAIRE DES PATIENTS QUI NE RÉPONDENT PAS AU TRAITEMENT DES SYMPTÔMES CUTANÉS DU LCCT6
AFIN DE CONTRIBUER AU TRAITEMENT DES MANIFESTATIONS CUTANÉES DU LCCT5
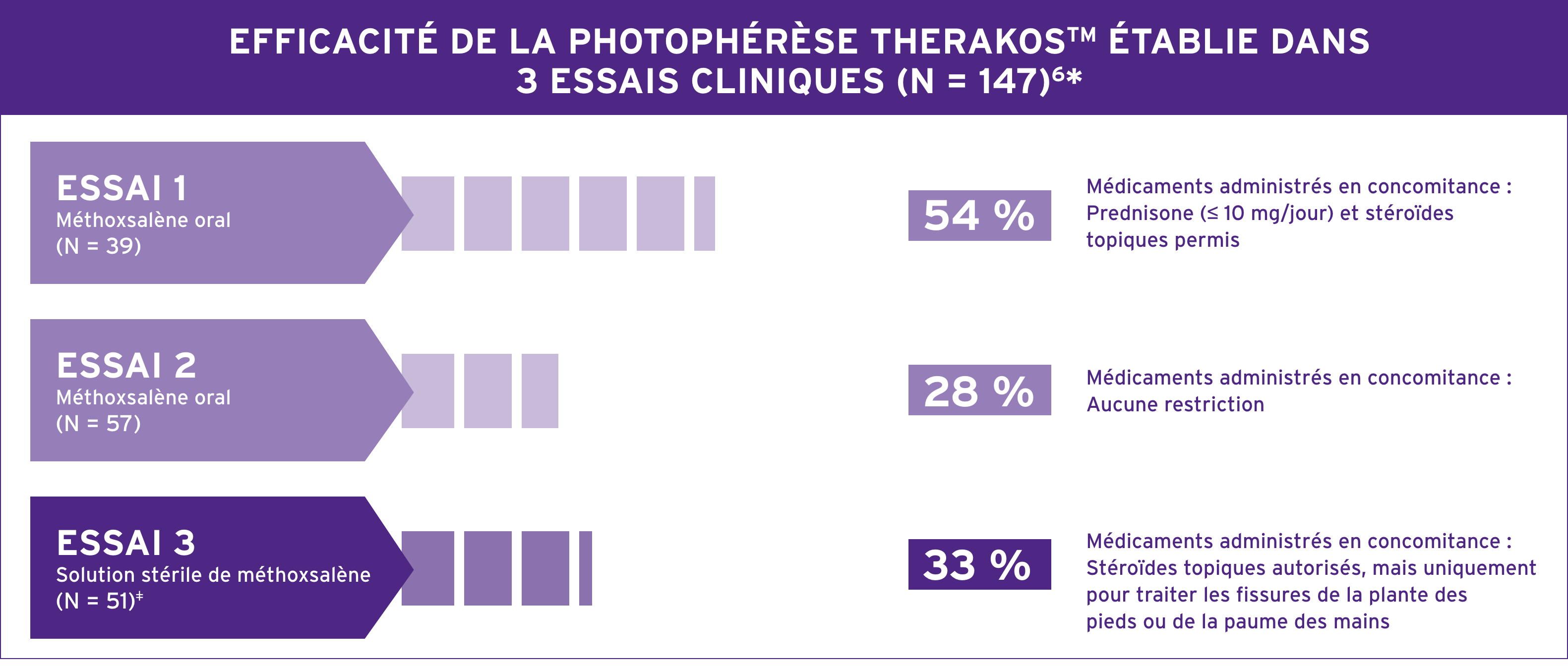
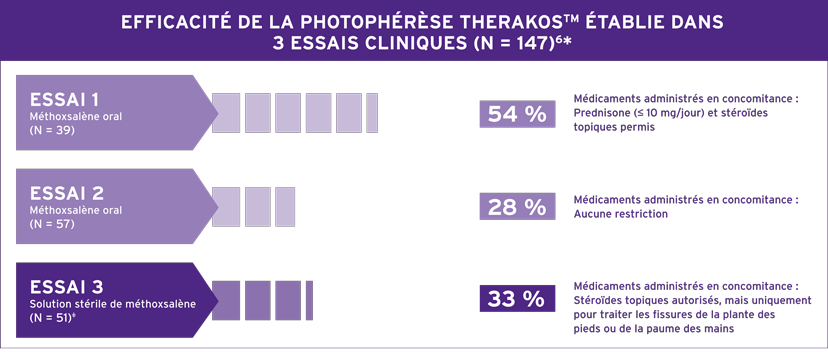
* Les résultats individuels peuvent varier. Des patients dont le LCCT, difficile à traiter, se caractérisait par des taches, des plaques étendues et une érythrodermie ont été admis à ces essais. Les patients étaient autorisés à recevoir certains agents topiques et/ou à action générale limités en association avec la photophérèse THERAKOS. La solution stérile de méthoxsalène est indiquée pour l’administration extracorporelle avec le système de photophérèse THERAKOS® CELLEX® dans le traitement palliatif des manifestations cutanées du LCCT ne répondant pas à d’autres formes de traitement6.
Trois essais cliniques ouverts multicentriques à un seul groupe ont été réalisés pour évaluer l’efficacité et l’innocuité de la photophérèse dans le traitement des manifestations cutanées du LCCT. Les scores cutanés globaux ont été utilisés dans les essais cliniques de l’ECP afin d’évaluer la réponse du patient au traitement. La réponse adéquate prédéfinie était une réduction de 25 % du score cutané par rapport au départ, maintenue pendant quatre semaines consécutives6. Tous les patients présentaient un LCCT difficile à traiter se caractérisant par des taches, des plaques étendues et une érythrodermie. Aucun patient en phase tumorale n’a été traité. Aucune donnée n’est disponible sur l’efficacité de la solution stérile de méthoxsalène chez les patients en phase tumorale.6
Plan de l’essai 1 (N = 39) : patients traités avec la formulation orale de méthoxsalène en concomitance avec le système de photophérèse UVAR XTS™. L’administration de prednisone jusqu’à 10 mg/jour était permise en plus de stéroïdes topiques. Les patients recevaient d’abord deux jours de traitement consécutifs toutes les quatre ou cinq semaines6. Le modèle de l’instrument particulier utilisé pour cette étude, le système de photophérèse UVAR XTS, n’est plus fabriqué ni pris en charge; il a été remplacé par le système de photophérèse THERAKOS CELLEX.
Plan de l’essai 2 (N = 57) : suivi d’une durée de cinq ans, à la suite d’une approbation, visant à évaluer
l’innocuité à long terme chez des patients atteints de LCCT. Dans cette étude, on a utilisé la formulation
orale de méthoxsalène. Il n’y avait pas de restriction en ce qui concerne les médicaments concomitants. Les
patients recevaient d’abord deux jours de traitement consécutifs toutes les quatre ou cinq semaines6
Plan de l’essai 3 (N = 51) : les patients ont été traités avec la solution stérile de méthoxsalène en concomitance
avec le système de photophérèse UVAR XTS. La dose totale de solution stérile de méthoxsalène distribuée était
considérablement plus faible (environ 200 fois) que celle utilisée lors de l’administration orale. Les stéroïdes
topiques étaient autorisés uniquement pour le traitement des fissures de la plante des pieds et de la paume
des mains. Tout autre stéroïde, topique ou systémique, était interdit. Les patients recevaient d’abord deux
jours de traitement consécutifs toutes les quatre ou cinq semaines. 15 réponses sur 17 ont été constatées au
cours des six mois suivant le début du traitement. Seulement deux patients ont réagi après six mois de traitement6.
Le modèle de l’instrument particulier utilisé pour cette étude, le système de photophérèse UVAR XTS, n’est
plus fabriqué ni pris en charge; il a été remplacé par le système de photophérèse THERAKOS CELLEX.
- Bien que les taux de réponse à la solution stérile de méthoxsalène dans l’essai 3 et au méthoxsalène oral dans l’essai 2 aient été similaires, la possibilité que l’efficacité de la solution stérile de méthoxsalène soit inférieure à celle du méthoxsalène oral ne peut être exclue en raison de la conception et de la taille des essais cliniques6
- Le taux de réponse plus élevé avec le méthoxsalène oral dans l’essai 1 peut être en partie attribuable à l’administration concomitante de stéroïdes à action générale, et au fait que les patients ont reçu plus de traitements par ECP (nombre moyen de traitements : essai 1 = 64, essai 2 = 31, essai 3 = 20)6
LES PATIENTS PRÉSENTANT DES MANIFESTATIONS CUTANÉES DU LCCT DOIVENT POURSUIVRE LE TRAITEMENT PENDANT AU MOINS 7 CYCLES6
- Dans l’essai 3, toutes les réponses, sauf deux, ont été obtenues dans les six mois suivant le début du traitement.
- Il n’y a aucune preuve clinique qu’un traitement à la solution stérile de méthoxsalène au-delà de six mois ou selon un calendrier différent offre un avantage supplémentaire.
UN TRAITEMENT BIEN TOLÉRÉ QUI FACILITE LA PRISE EN CHARGE DES MANIFESTATIONS CUTANÉES DU LCCT6*
- Les événements indésirables (EI) observés pendant les essais cliniques étaient principalement liés à l’hypotension secondaire due aux variations du volume extracorporel (> 1 %).
- Pendant l’essai 3:
- Six EI cardiovasculaires graves (dont 5 n’étant pas liés à la photophérèse) ont été signalés chez 5 patients (10 %).
- Six infections ont également été signalées chez 5 patients.
- Deux d’entre elles étaient des infections de cathéter de Hickman chez 1 patient.
- Les réactions médicamenteuses indésirables les plus souvent signalées après la mise en vente du traitement à la solution stérile de méthoxsalène/ECP indépendamment de l’évaluation de la causalité proviennent de signalements spontanés, d’études ou d’ouvrages cliniques et incluent des perversions de goût, une attaque vaso-vagale/évanouissement/vertiges, une septicémie/septicémie due au cathéter, une anémie, une hypotension et des nausées.
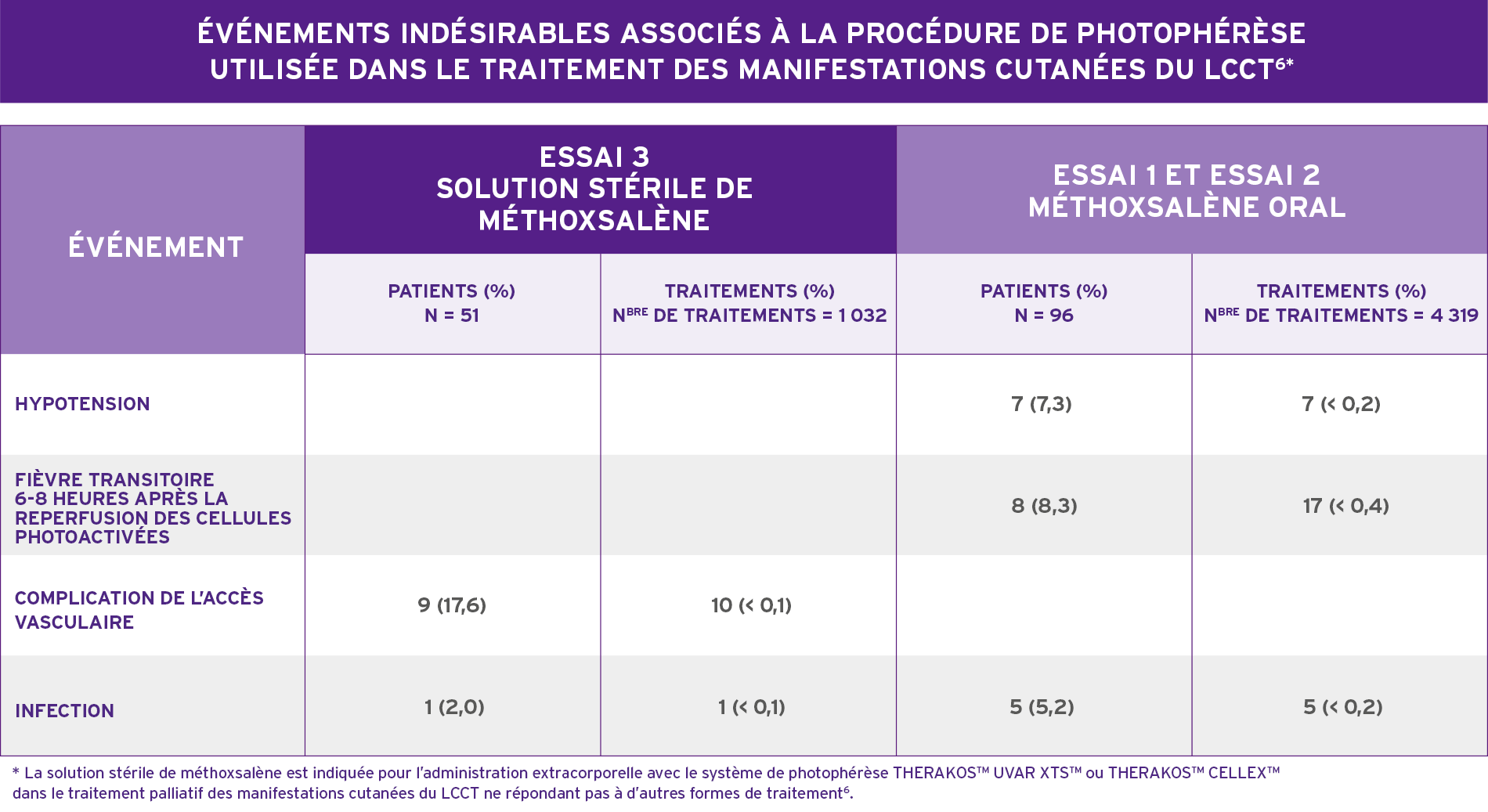
*La solution stérile de méthoxsalène est indiquée pour l’administration extracorporelle avec le système de photophérèse THERAKOS® UVAR XTS™ ou THERAKOS® CELLEX® dans le traitement palliatif des manifestations cutanées du LCCT ne répondant pas à d’autres formes de traitement6.
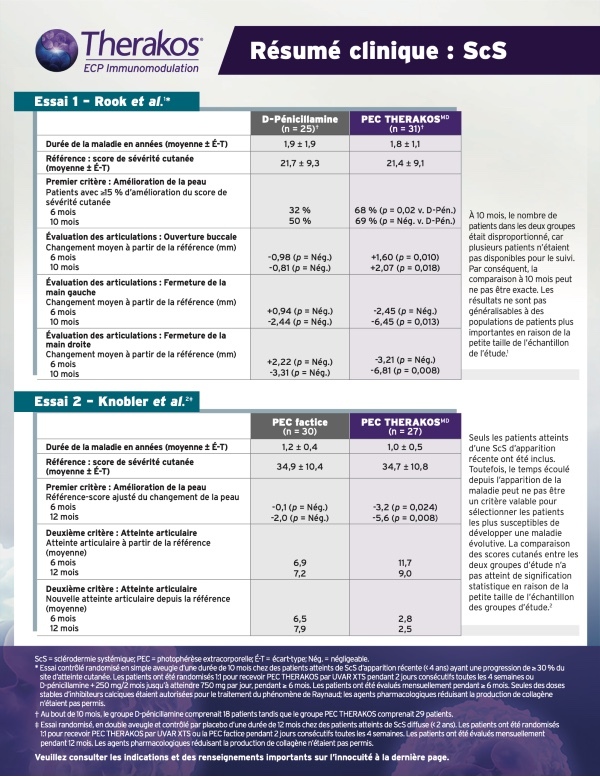
SCLÉRODERMIE GÉNÉRALISÉE
AMÉLIORATION STATISTIQUEMENT SIGNIFICATIVE DU SCORE CUTANÉ APRÈS 6 MOIS7*
LA PHOTOPHÉRÈSE THERAKOS EXPLOITE LE SYSTÈME IMMUNITAIRE POUR CONTRIBUER AU TRAITEMENT DE LA SCLÉRODERMIE GÉNÉRALISÉE5 CHEZ LES PATIENTS DONT LA MALADIE EST PRÉCOCE ET DIFFUSE5
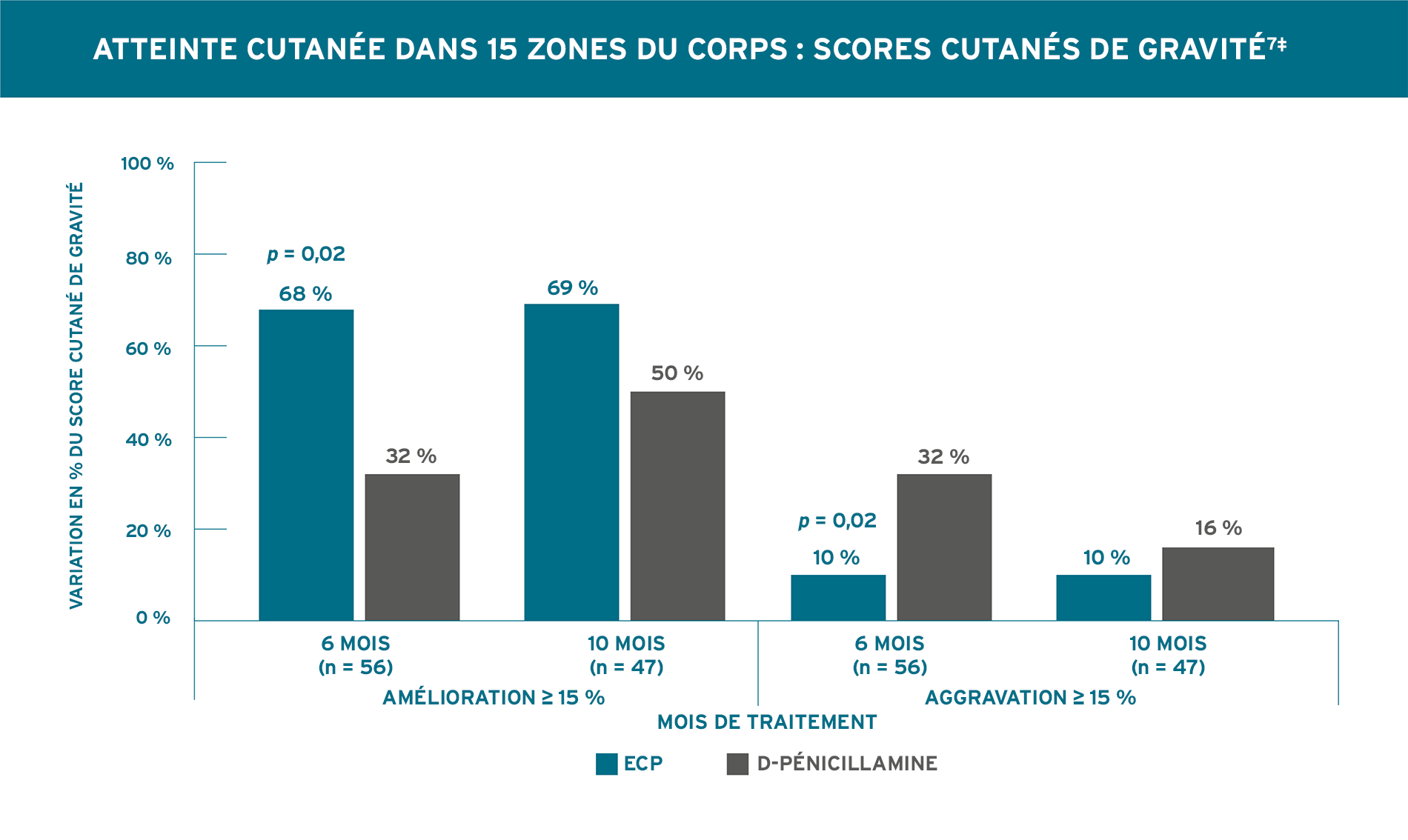
Rook, 1992. Plan de l’essai (N = 56) : essai à simple insu contrôlé d’une durée de 10 mois, à répartition aléatoire, chez des patients atteints de sclérodermie généralisée de survenue récente. Les résultats comprenaient le score cutané, évalué en notant l’épaisseur de la peau sur une échelle de 0 à 3 sur 15 zones du corps, avec des scores cutanés de gravité possibles allant de 0 à 45; les articulations ont été évaluées par mesure normalisée de la variation de l’ouverture buccale et de la fermeture de la main droite et de la main gauche. Tous les patients présentaient une sclérodermie généralisée de survenue récente (durée < 4 ans) et une progression ≥ 30 % au site d’atteinte cutanée. Les patients ont été répartis aléatoirement selon un rapport 1:1 pour recevoir l’ECP, 2 jours consécutifs, toutes les 4 semaines (n = 31) ou la D-pénicillamine (n = 25) à 750 mg/jour (la dose a été augmentée de 250 mg tous les 2 mois jusqu’à l’atteinte d’une dose de 750 mg/jour). Les patients ont été évalués tous les mois pendant une durée minimale de 6 mois. Les agents pharmacologiques qui réduisent la production de collagène, comme les stéroïdes, la colchicine, l’aminobenzoate de potassium et la griséofulvine, n’étaient pas autorisés pendant l’étude. Pour le traitement du phénomène de Raynaud, seules les doses stables de bloqueurs des canaux calciques ont été autorisées7.
* Aucune amélioration significative du score cutané des patients traités par l’ECP n’a été observée après 10 mois par rapport à ceux qui étaient traités par la D-pénicillamine7. † Une modification du score cutané pendant le traitement a été considérée comme cliniquement pertinente si elle différait d’au moins 15 % par rapport au départ7.
AMÉLIORATION SIGNIFICATIVE PAR RAPPORT AU DÉPART DE L’OUVERTURE BUCCALE APRÈS 6 MOIS, ET DE L’OUVERTURE BUCCALE ET DE LA FERMETURE DE LA MAIN DROITE/GAUCHE APRÈS 10 MOIS7
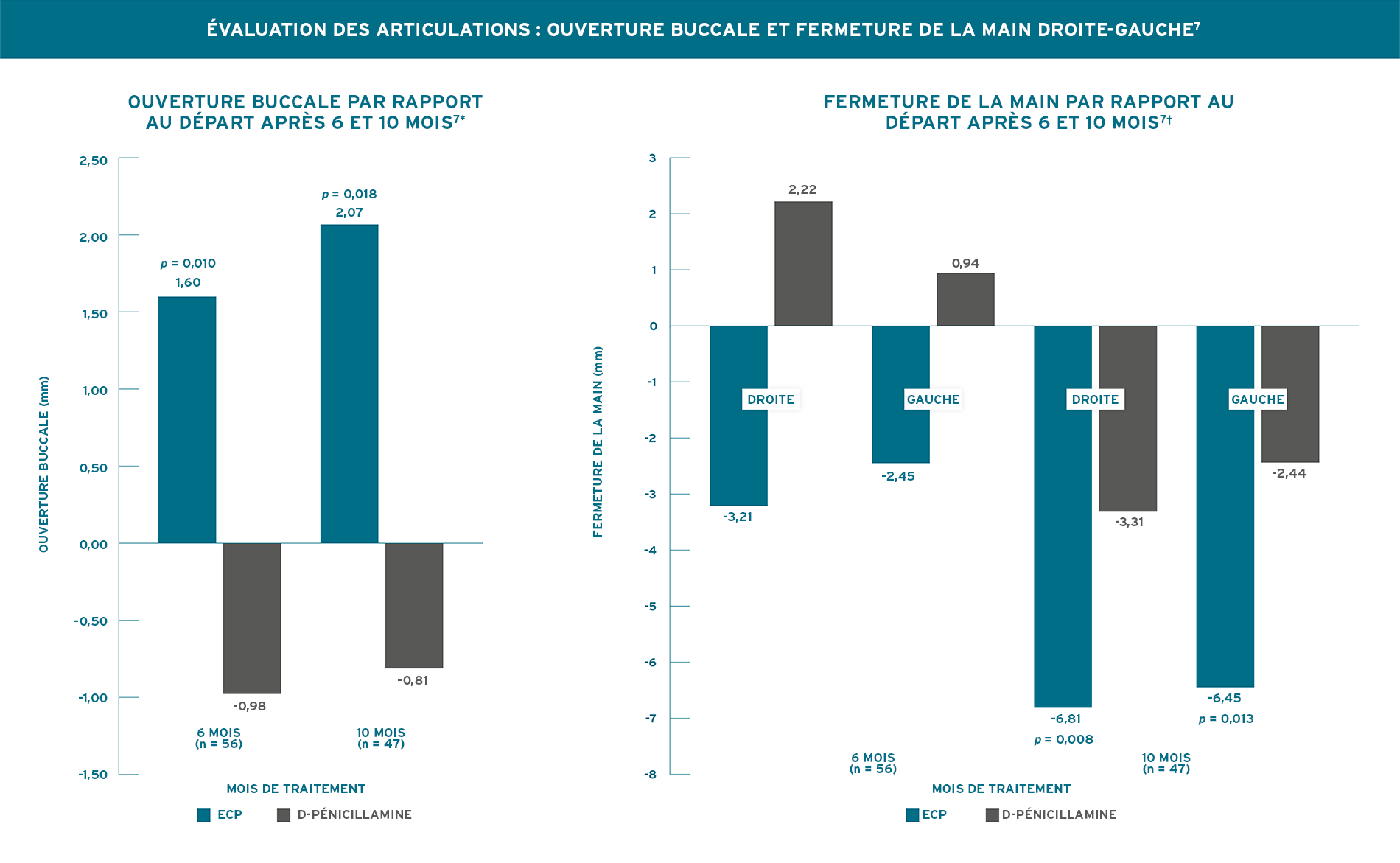
Rook, 1992. Plan de l’essai (N = 56) : essai à simple insu contrôlé d’une durée de 10 mois, à répartition aléatoire, chez des patients atteints de sclérodermie généralisée de survenue récente. Les résultats comprenaient le score cutané, évalué en notant l’épaisseur de la peau sur une échelle de 0 à 3 sur 15 zones du corps, avec des scores cutanés de gravité possibles allant de 0 à 45; les articulations ont été évaluées par mesure normalisée de la variation de l’ouverture buccale et de la fermeture de la main droite et de la main gauche. Tous les patients présentaient une sclérodermie généralisée de survenue récente (durée < 4 ans) et une progression >= 30 % au site d’atteinte cutanée. Les patients ont été répartis aléatoirement selon un rapport 1:1 pour recevoir l’ECP, 2 jours consécutifs, toutes les 4 semaines (n = 31) ou la D-pénicillamine (n = 25) à 750 mg/jour (la dose a été augmentée de 250 mg tous les 2 mois jusqu’à l’atteinte d’une dose de 750 mg/jour). Les patients ont été évalués tous les mois pendant une durée minimale de 6 mois. Les agents pharmacologiques qui réduisent la production de collagène, comme les stéroïdes, la colchicine, l’aminobenzoate de potassium et la griséofulvine, n’étaient pas autorisés pendant l’étude. Pour le traitement du phénomène de Raynaud, seules les doses stables de bloqueurs des canaux calciques ont été autorisées7.
* Aucune amélioration significative de l’ouverture buccale des patients traités par la D-pénicillamine n’a été observée par rapport au départ7. † Aucune amélioration significative de la fermeture de la main des patients traités par l’ECP par rapport au départ n’a été observée après 6 mois. Aucune amélioration significative de la fermeture de la main des patients traités par la D-pénicillamine n’a été observée par rapport au départ7.
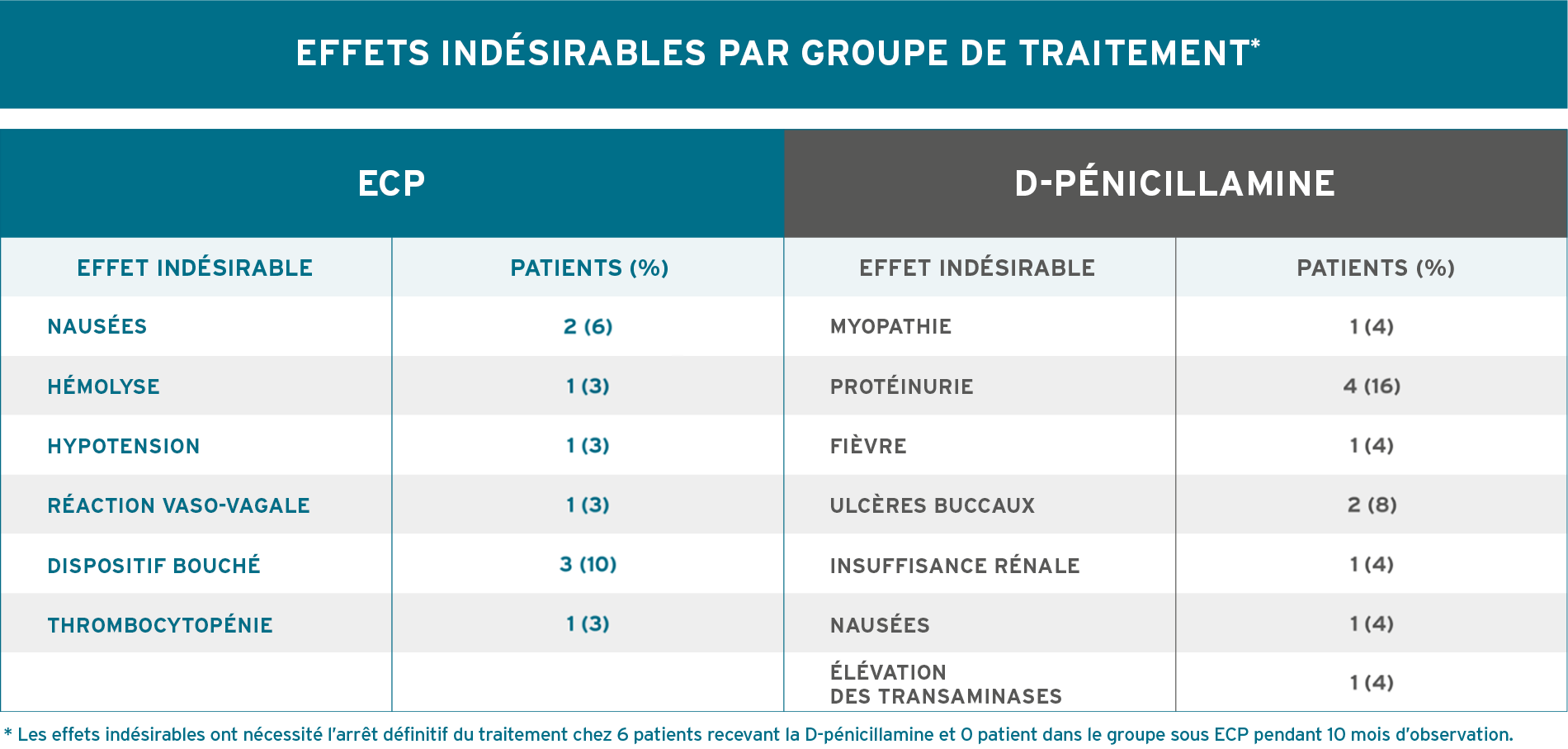
AMÉLIORATION DE LA PEAU STATISTIQUEMENT SIGNIFICATIVE PAR RAPPORT AU DÉPART AUX MOIS 6 ET 128
Knobler, 2006. Plan de l’essai (N = 57) : essai à double insu contrôlé par placebo, d’une durée de 12 mois, à répartition aléatoire, chez des patients atteints de sclérodermie généralisée diffuse. Le critère d’évaluation principal était la diminution de l’atteinte cutanée évaluée par un score cutané dans 22 zones, avec la méthode modifiée de score cutané dans la sclérodermie recommandée par Kahaleh et al., Clin Exp Rheumatol 1986;4:367-369. Le critère d’évaluation secondaire était la variation de l’atteinte articulaire mesurée à l’aide d’un goniomètre. Tous les patients présentaient une sclérodermie généralisée diffuse, et l’apparition de la maladie datait de moins de 2 ans. Les patients ont été répartis aléatoirement selon un rapport 1:1 pour recevoir une photophérèse, 2 jours consécutifs, toutes les 4 semaines (n = 27) ou une fausse photophérèse, 2 jours consécutifs, toutes les 4 semaines (n = 30). Les patients ont été évalués tous les mois pendant 12 mois. Les agents pharmacologiques qui réduisent la production de collagène, notamment les corticostéroïdes, la colchicine, la griséofulvine et la D-pénicillamine, n’étaient pas autorisés8.
* La comparaison des scores cutanés entre les deux groupes de l’étude n’a pas atteint une valeur statistique en raison de la petite taille des échantillons de ces groupes8.
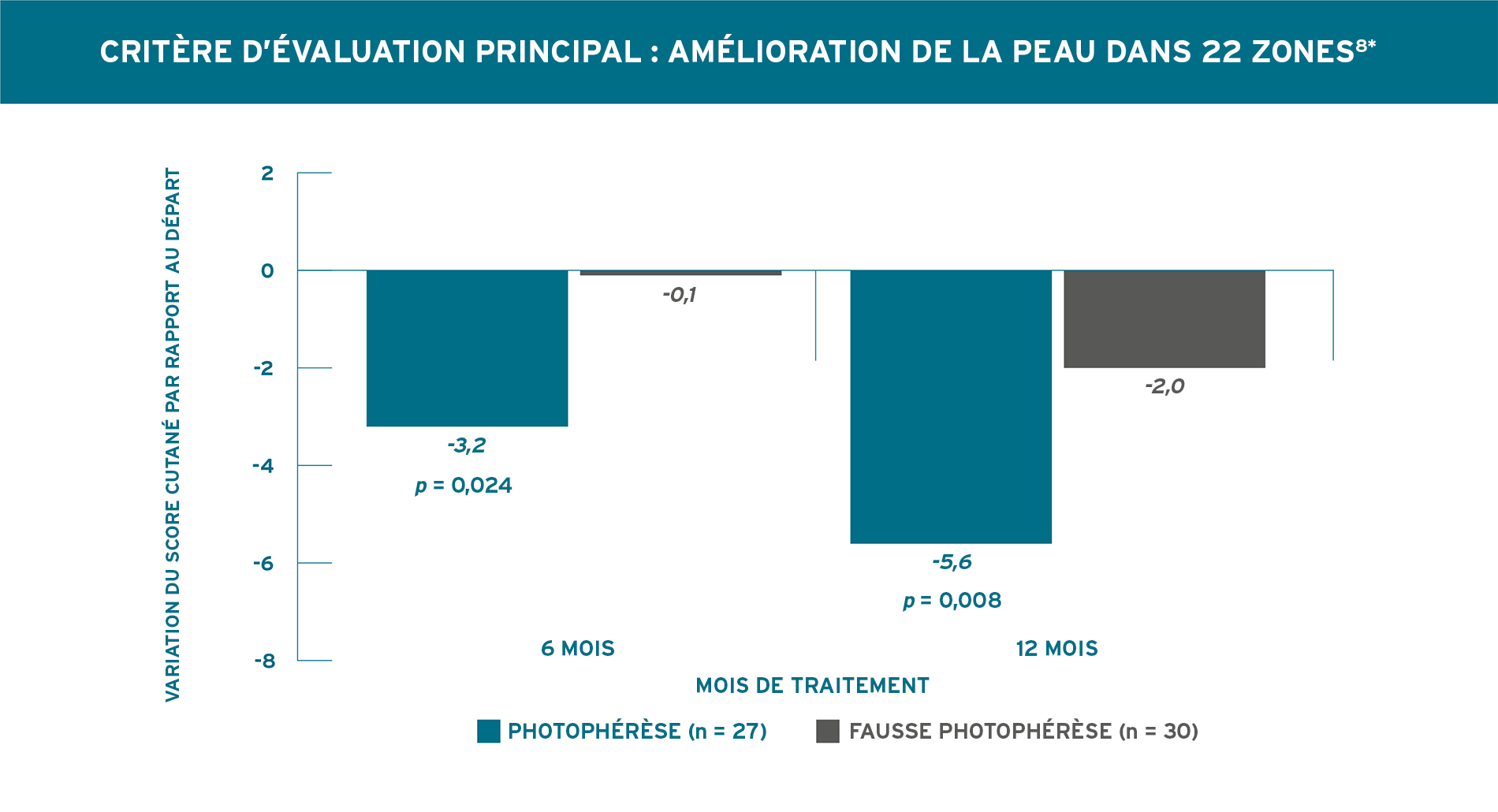
UNE AMÉLIORATION STATISTIQUEMENT SIGNIFICATIVE PAR RAPPORT AU DÉPART DANS UN PLUS GRAND NOMBRE D’ARTICULATIONS,
ET MOINS DE NOUVELLES ARTICULATIONS ATTEINTES APRÈS 6 ET 12 MOIS8
Knobler, 2006. Plan de l’essai (N = 57) : essai à double insu contrôlé par placebo, d’une durée de 12 mois, à répartition aléatoire, chez des patients atteints de sclérodermie généralisée diffuse. Le critère d’évaluation principal était la diminution de l’atteinte cutanée évaluée par un score cutané dans 22 zones, avec la méthode modifiée de score cutané dans la sclérodermie recommandée par Kahaleh et al., Clin Exp Rheumatol 1986;4:367-369. Le critère d’évaluation secondaire était la variation de l’atteinte articulaire mesurée à l’aide d’un goniomètre. Tous les patients présentaient une sclérodermie généralisée diffuse, et l’apparition de la maladie datait de moins de 2 ans. Les patients ont été répartis aléatoirement selon un rapport 1:1 pour recevoir une photophérèse, 2 jours consécutifs, toutes les 4 semaines (n = 27) ou une fausse photophérèse, 2 jours consécutifs, toutes les 4 semaines (n = 30). Les patients ont été évalués tous les mois pendant 12 mois. Les agents pharmacologiques qui réduisent la production de collagène, notamment les corticostéroïdes, la colchicine, la griséofulvine et la D-pénicillamine, n’étaient pas autorisés8.
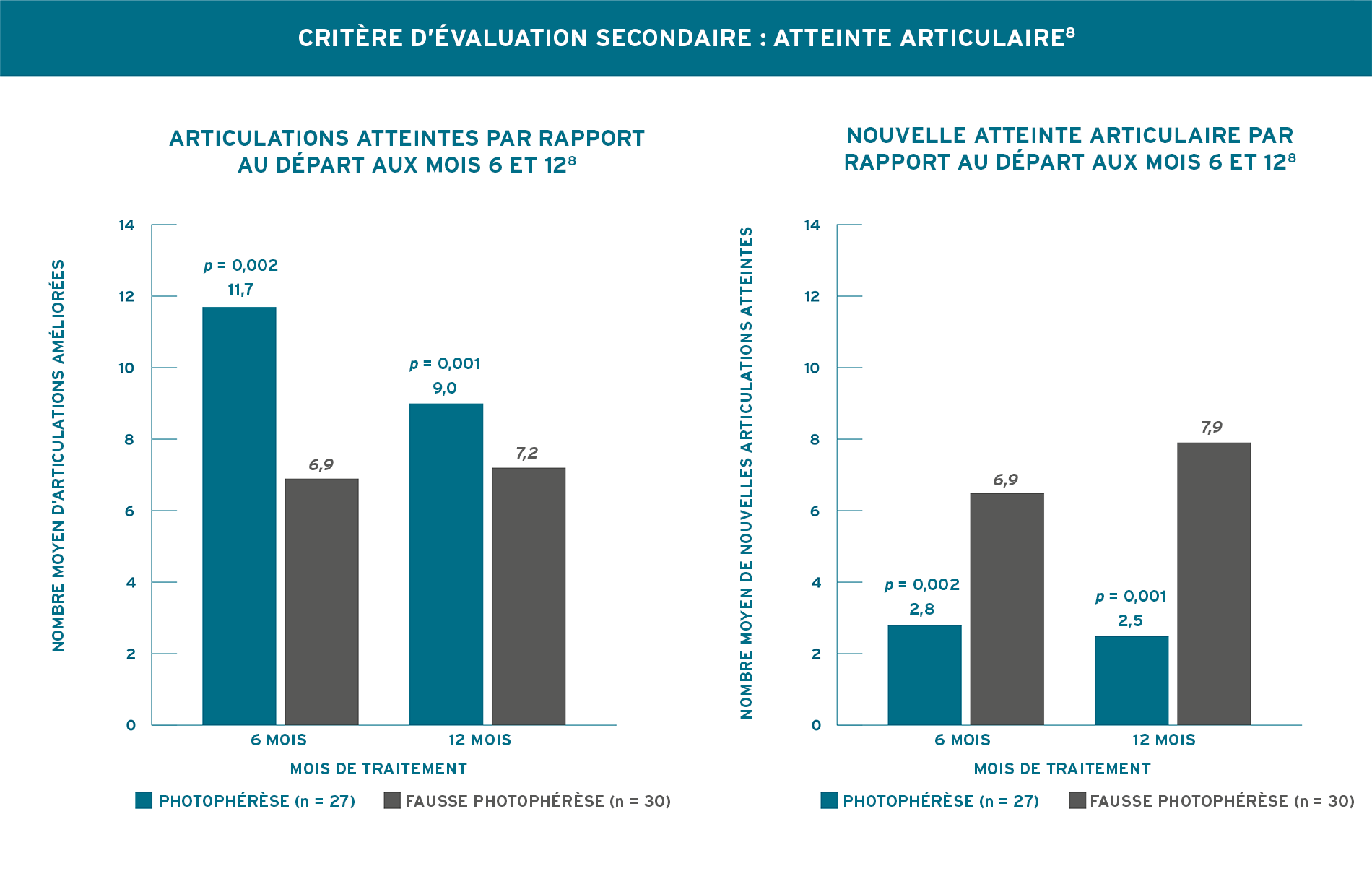
MODALITÉ DE TRAITEMENT BIEN TOLÉRÉE QUI PEUT AIDER À PRENDRE EN CHARGE LES MANIFESTATIONS CUTANÉES DE LA SCLÉRODERMIE GÉNÉRALISÉE8
UN PROFIL DE TOLÉRABILITÉ ÉTABLI8
- Aucun effet indésirable grave et aucune différence significative dans les effets indésirables globaux n’ont été signalés entre les groupes de l’étude.
SYSTÈME DE PHOTOPHÉRÈSE THERAKOS® CELLEX®
CONÇU POUR L’EXCELLENCE EN MATIÈRE D’ECP
LE SYSTÈME CELLEX® EST LE SEUL SYSTÈME D’ECP ENTIÈREMENT INTÉGRÉ ET VALIDÉ AU CANADA, CONÇU POUR RÉPONDRE À VOS BESOINS ET À CEUX DE VOS PATIENTS3.

EXPÉRIENCE ET CERTIFICATION
DÉVELOPPEMENT DE SOLUTIONS D’ECP (PRODUITS, SERVICES ET FORMATION) DEPUIS 19873
LES SYSTÈMES DE PHOTOPHÉRÈSE THERAKOS® CELLEX® ONT UNE PORTÉE MONDIALE9

Utilisés par > 300 centres de traitement

Dans > 30 pays

Des trousses d’ECP sont actuellement fournies à plus de 135 000 patients par année

> 2 millions de traitements en plus de 35 ans
LE SYSTÈME DE PHOTOPHÉRÈSE THERAKOS CELLEX SATISFAIT AUX NORMES MONDIALES DE QUALITÉ SUIVANTES :
- Certifié ISO 13485:20039*
- Système de gestion de la qualité THERAKOS certifié pour la conception, la fabrication, la distribution et l’entretien des systèmes de photophérèse
- Déclaration de conformité du Conseil européen10
- Directive relative aux dispositifs médicaux 93/42/CEE9,10 (spécifique au Royaume-Uni)
- Satisfait à l’exigence selon laquelle les appareils peuvent être utilisés en toute sécurité avec les matériaux, substances et gaz avec lesquels ils entrent en contact
- Satisfait à l’exigence selon laquelle le rendement est maintenu conformément à l’utilisation prévue
* Certifié par un organisme notifié (certificat d’enregistrement BSI numéro FM 72801)9. L’Organisation internationale de normalisation (ISO) spécifie les exigences relatives à un système de gestion de la qualité. Les entreprises utilisent les normes ISO pour démontrer leur capacité à fournir de manière constante des produits et des services qui répondent aux exigences des clients et aux exigences réglementaires11. La norme ISO 13485:2003 spécifie les exigences relatives aux systèmes de gestion de la qualité pour les dispositifs médicaux et les services associés.12
CERTAINES CARACTÉRISTIQUES DU SYSTÈME
LE SEUL SYSTÈME D’ECP ENTIÈREMENT INTÉGRÉ AU CANADA3





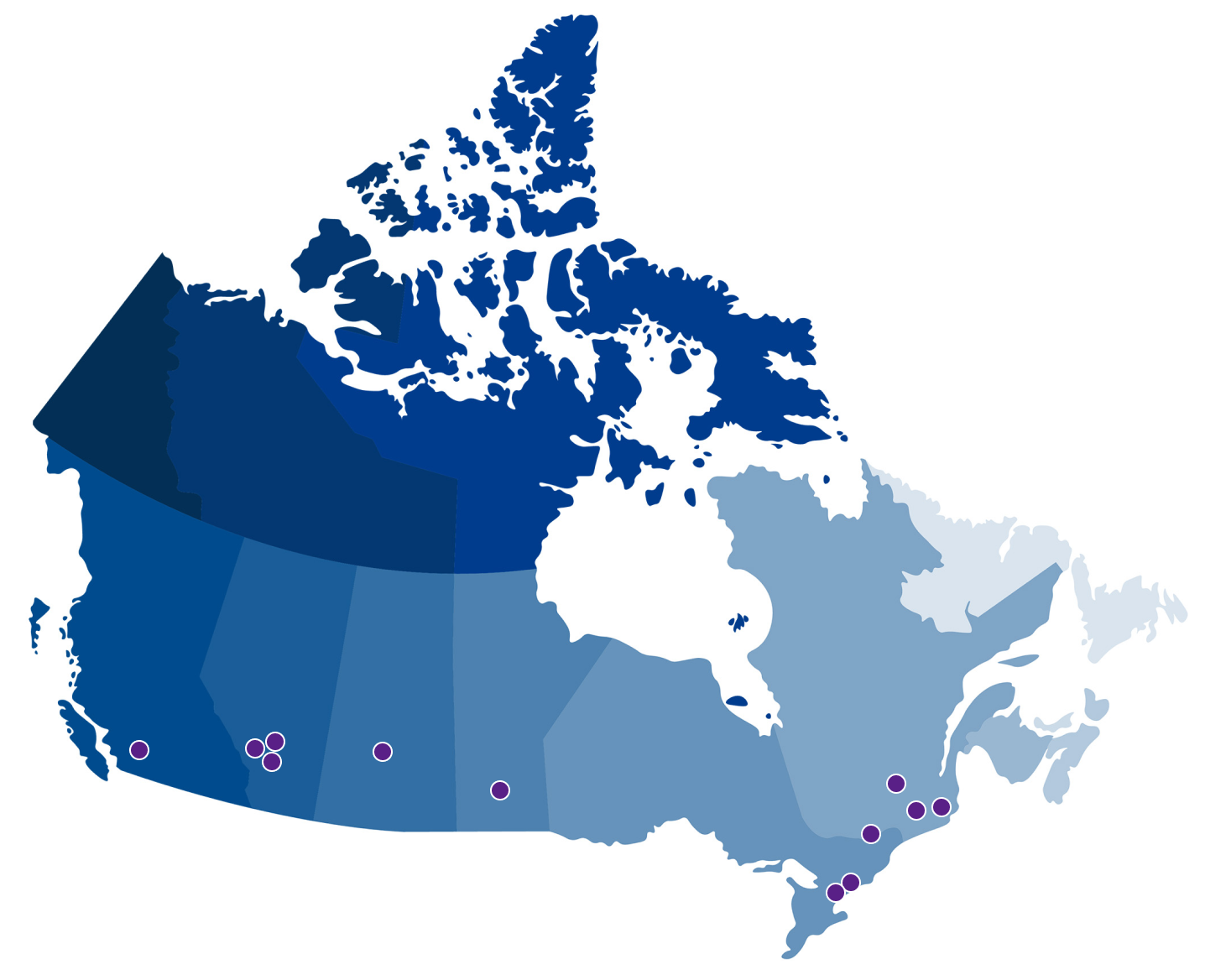
DISPONIBILITÉ – CENTRES DE TRAITEMENT PAR ECP
De plus en plus de centres au Canada proposent le traitement par photophérèse THERAKOS. Ce sont des établissements tiers indépendants dont Therakos (Canada) n’est ni propriétaire ni administrateur. Les renseignements sur les centres de traitement sont fournis à titre d’information seulement, sous réserve de changement, et ne sont peut-être pas exhaustifs.
POUR OBTENIR DES RENSEIGNEMENTS SUR LA MANIÈRE DE COMMUNIQUER AVEC LE DIRECTEUR DE L’ECP D’UN CENTRE DE TRAITEMENT PARTICULIER, VEUILLEZ REMPLIR UN FORMULAIRE DE DEMANDE GÉNÉRALE.
RESSOURCES
RESSOURCES POUR LES PROFESSIONNELS
AUTRES ACTIVITÉS D’APPRENTISSAGE
Pour recevoir des invitations aux webinaires prévus ou des renseignements sur la façon de participer à d’autres activités d’apprentissage, veuillez remplir un formulaire de demande générale.
BROCHURES À TÉLÉCHARGER
SERVICE À LA CLIENTÈLE THERAKOS ONE TEAM
NOTRE ÉQUIPE D’ASSISTANCE INTERNE SPÉCIALISÉE VOUS AIDERA À ASSURER UNE ADMINISTRATION OPTIMALE DES TRAITEMENTS D’ECP À VOS PATIENTS. AVEC TOUTES NOS INITIATIVES D’APPRENTISSAGE, NOUS VISONS À SATISFAIRE LES NORMES LES PLUS ÉLEVÉES ET À CONTRIBUER À LA CRÉATION D’UNE COMMUNAUTÉ MÉDICALE MIEUX INFORMÉE ET PLUS APTE À ADMINISTRER L’IMMUNOMODULATION PAR ECP AUX PATIENTS.
SOLUTIONS THERAKOS ONE TEAM
- Formation opérationnelle et dépannage
- Réparation et entretien de l’appareil*
- Prise de commande et livraison
- Options et adaptations de contrat

Une équipe entièrement intégrée permet une meilleure supervision de la qualité et un service amélioré dans l’ensemble.

Ligne directe de soutien bilingue disponible
- Service à la clientèle
- Soutien technique et clinique

Services rapides pour les réparations
- 24 heures pour les réparations urgentes*
- 48 heures pour les réparations non urgentes†
Références :
- Therakos, Inc. Manuel de l’opérateur. Système de photophérèse THERAKOS® CELLEX®.
- Bisaccia E, et al. Br J Dermatol. 2009;161(1):167-169.
- Knobler R, et al. J Eur Acad Dermatol Venereol. 2014;28(suppl 1):1-37.
- Perotti C, Sniecinski I. Transfus Apher Sci. 2015;52:360-368.
- Hart JW, et al. Ther Adv Hematol. 2013;4:320-334.
- Monographie d’UVADEX (méthoxsalène). West Chester, Pennsylvanie, États-Unis : Therakos, Inc. : mai 2013.
- Rook AH, et al. Arch Dermatol. 1992;128:337-346.
- Knobler R, et al. J Am Acad Dermatol. 2006;54:793-799.
- Therakos (Canada) Company. Données internes. Février 2021.
- Conseil européen. Directive 93/42/CEE du Conseil. Disponible à: https://eur-lex.europa.eu/legal-content/FR/TXT/PDF/?uri=CELEX:31993L0042&from=FR. Consulté le 9 février 2021.
- Organisation internationale de normalisation. ISO 9001:2015 Systèmes de management de la qualité – Exigences. Publication en ligne en septembre 2019. https://www.iso.org/fr/standard/62085.html. Consulté le 16 mars 2021.
- Organisation internationale de normalisation. ISO 13485:2003 Dispositifs médicaux – Systèmes de management de la qualité – Exigences à des fins réglementaires. Publication en ligne en juillet 2003. https://www.iso.org/fr/standard/36786.html. Consulté le 16 mars 2021.
References:
- Knobler R, et al. J Eur Acad Dermatol Venereol. 2014;28(suppl 1):1-37.
- Health Canada Medical Devices Active Licence Listing Database. https://health-products.canada.ca/mdall-limh/information.do?companyId_idCompanie=129103&lang=eng. Accessed May 27, 2021.
- Therakos LLC. Data on File. February 2021.
References:
- Therakos, Inc. Operator’s Manual. THERAKOS™ CELLEX™ Photopheresis System.
- Bisaccia E, et al. Br J Dermatol. 2009;161(1):167-169.
- Knobler R, et al. J Eur Acad Dermatol Venereol. 2014;28(suppl 1):1-37.
- Perotti C, Sniecinski I. Transfus Apher Sci. 2015;52(3):360-368.
- Hart JW, et al. Ther Adv Hematol. 2013;4:320-334.
- UVADEX (methoxsalen) Product Monograph. West Chester, PA, USA: Therakos, Inc.: May 2013.
- Rook AH, et al. Arch Dermatol. 1992;128(3):337-346.
- Knobler R, et al. J Am Acad Dermatol. 2006;54:793-799.
- Therakos LLC. Data on File. February 2021.
- European Council. Council Directive 93/42/EEC. Available at: https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:31993L0042&from=EN. Accessed February 9, 2021.
- International Organization for Standardization. ISO 9001:2015 Quality Management Systems – Requirements. Published online September 2019. https://www.iso.org/standard/62085.html. Accessed March 16, 2021.
- International Organization for Standardization. ISO 13485:2003 Medical Devices – Quality Management Systems – Requirements for Regulatory Purposes. Published online July 2003. https://www.iso.org/standard/36786.html. Accessed March 16, 2021.